السلام عليكم ورحمة الله وبركاته
مرحبا! انقطعت لفترة، تعلمت فيها أمور جديدة الحمدلله، ولعلها انتهت الآن، لذلك تفرغت للكتابة.
الورقة العلمية هذه لها مكانة كبيرة عندي، لأني تعلمت منها أشياء كثيرة جدا جدا جدا، وجديدة، سواء مفاهيم علمية، أو تكنيكات معملية، بصراحة ارتفع سقف اختياراتي بعدها.
أولا، أحتاج أشرح بعض المصطلحات الموجودة في العنوان، ثم أتكلم عن البحث والهدف منه.
PTBP1: بروتين لديه القدرى على الإرتباط بالـ RNA.
Alternative Splicing: في الغالب، الجين الواحد يعطي أكثر من بروتين نسميهم “isoforms”، والكيفية هي أن الجين يُنسخ كـ immature mRNA، تجري عليه بعض التعديلات مثل قطع بعض الأجزاء “exons” وترك أخرى، وهذا يُنتج لنا بروتين مختلف في كل مرة، نسمي عملية القطع هذه بـ Alternative splicing.
Inflammatory Secretome: بروتينات،يتم إفرازها من الخلية عند حدوث أي خلل غير طبيعي، تلف النسيج، أو عدوى من كائنات دقيقة. تعمل هذه البروتينات كمُراسِلات توجه الخلايا المناعية إلى مكان الخلايا المُفرِزه، وتحفز بعض التفاعلات بين الخلية المُفرِزة والخلايا المجاورة لها، وأيضا الخلايا المناعية التي تم جلبها/توجيهها من الأوعية الدموية.
بالعموم، الـ inflammation يتلخص بكونه عملية مراسلات تحدث بين الخلية المُرسِلة وبين العديد من الخلايا “المجاورة عادة، والمناعية غالبا” لإخبارهم بحالتها، والهدف منها إعادة التوازن في الجسم (على مستوى الخلايا) والتخلص من المشكلة المُحفزة. أحيانا تستمر عملية إفراز هذه البروتينات لاستمرار المُسبب مما يؤدي إلى أمراض عديدة، من أبرزها السرطان! لأن هذه البروتينات تؤثر على بقية الخلايا وعلى الـ DNA بشكل سلبي مع مرور الوقت.
Senescent Cells:
الخلية الهَرِمة:
في الستينات الميلادية اكتشف العلماء أن بعض الخلايا تدخل في مرحلة أسموها “الشيخوخة”، مما يعني أن الخلية الهَرِمة هذه تتوقف تماما عن الإنقسام، وتطلق بروتينات تجذب الخلايا المناعية “Macrophages” حتى تبتلعها وتزيلها. وجد العلماء وقتها أن بعض الخلايا القابلة للتحول لخلايا سرطانية، تُفعل هذا النظام مما ييساعد النظام المناعي على إزالتها، فافترض العلماء أن عملية الشيخوخة هذه تعتبر مثبطة للأورام
(tumor-suppressive mechanism)
ولكن بعدها بفترة وجدوا أن وجود خلايا هَرِمة قد يساهم في تحفيز نمو الأورام، ولو كانت موجودة في
البيئة المحيطة بالورم (microenviroment) قد تزيد من سوءه وتحفز توغله وانتشاره!
لفهم سبب هذا التداخل والتناقض الظاهر، لنفهم بعض النقاط الخاصة بشيخوخة الخلايا بشكل عام:
1- الخلية تدخل لمرحلة الشيخوخة لأسباب مختلفة، إما لأنها بلغت أقصى حدود الإنقسام الخلوي، فالتيلومير الخاص بها لايمكنه دعم الإنقسام أكثر (Achieve Hayflick limit) لذا تتوقف. وإما بسبب تنشيط بعض الجينات السرطانية (Oncogen-induce senescence) أو بسبب تلف الـ DNA، وغير ذلك.
2- تتميز الخلايا الهَرِمة بتوقفها التام عن الإنقسام، وللتأكد من ذلك يدرس العلماء التعبير الجيني الخاص بمثبطات تقدم الإنقسام الخلوي cell cycle inhibitor p16INK4A or p21
إذا كان مستوى البروتين عالي = الخلية لا تنقسم.
3- تطلق الخلايا الهَرِمة نمط من الإفرازات يُسمى (senescence- associated secretory phenotype) بإختصار (SASP)
هي عبارة عن بروتينات مختلفة، مثل السيتوكينات، الأنزيمات المحطمة للبروتينات، عوامل النمو، و chemokines. لكن:
-العوامل المفرزة هذه ليست خاصة ومميزة للخلية الهرمة، كثير من الخلايا تفرزها أيضا وتعمل وظائف
متنوعة “لكن لاحظوا أنه في بقية الخلايا عادة، يكون إفراز البروتين مؤقت، بعكس الخلية الهَرِمة، يكون دائم”.
-يختلف نوع وكمية الإفرازات من خلية هَرِمة لأخرى، بناء على نوع الخلية، ونوع النسيج، وسبب تحفيز
شيخوختها (هل بسبب DNA damage مثلا، أم التيلومير..إلخ).
-هذه الإفرازات (SASP) لها تأثير تحفيزي للورم، وأحيانا تثبيطي، على حسب نمط الإفراز الخاص بها،
والذي -كما قلنا- يختلف باختلاف النسيج وأصل الخلايا ومحَفِز الشيخوخة.
–الـSASP المُفرَزه تؤثر على الخلية ذاتها (autocrine effect) والخلايا المجاورة (paracrine effect) حيث تحفزهم ليدخلوا مرحلة الشيخوخة أيضا.
حتى الآن، لم يجد العلماء طريقة بواسطتها يعرفون سبب إختلاف الـ SASP من خلية هَرِمة لأخرى، ولكن، القليل من الدراسات بدأت تأخذ نوع واحد من الخلايا وتحفز فيها الشيخوخة بطرق مختلفة، ثم تقارن ال
SASP المفرزة من خلية لأخرى. ومن الواضح أنه كلما كان المُحَفِز للشيخوخة هو تلف الـ DNA فالـ SASP
تكون غالبا محفزة للأورام.
في النهاية، عوامل عديدة متغيرة هي من تحدد هل الخلية الهَرمة ستحفز نمو الورم أم تثبيطه؟ وكما قالوا في المرجع الذي نقلت منه:
“There is no ‘one size fits all’ description or impact of senescent cells on tumorigenesis”.
الآن ندخل على البحث والهدف منه.
____________________________________________________________________________
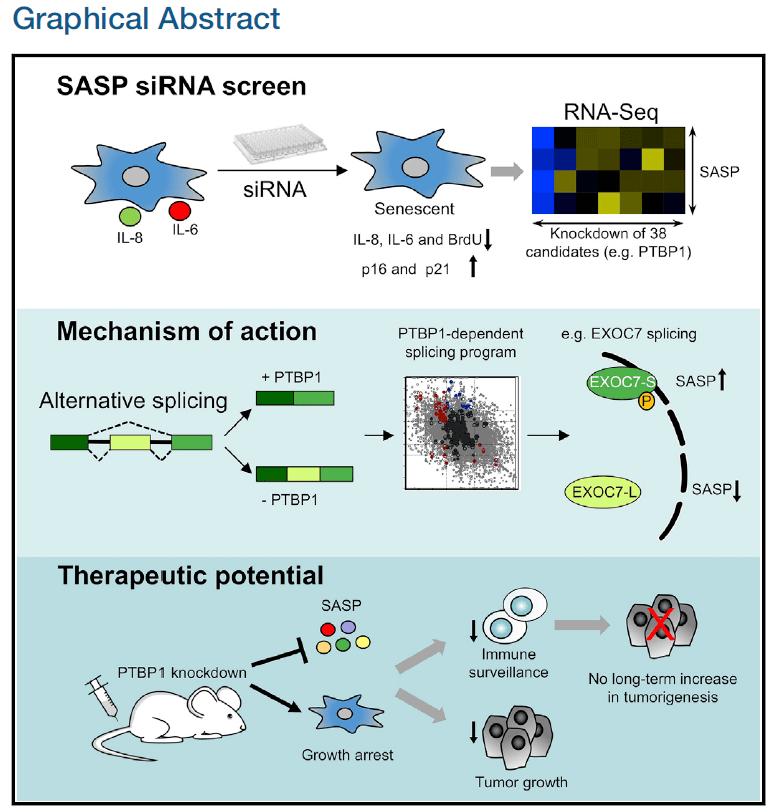
نعرف الآن أن الـ SASP المُفرزه من الخلية الهَرِمة هي بروتينات عديدة بعضها يعتبر inflammatory factors بمعنى أنه يعزز عملية الـ inflammation واللي بدورها تزيد من عدوانية الورم. كان الهدف من البحث هو دراسة الجينات التي تتفعل في حالة الشيخوخة، لتعطي بروتينات الـ SASP، ثم محاولة استهدافها، وفي نفس الوقت، يجب أن تحافظ الخلية على حالة التوقف التام عن الإنقسام، لأنها لو عادت تنقسم فإحتمال كبير تتحول لخلية سرطانية. إذن الفكرة بالخطوات:
1- التعرف على ماهية الـ SASP في الخلايا المدروسة في البحث.
2- التعرف على البروتينات المنظمة لها والتي تتحكم بها.
3- اسهداف هذه المنظمات، لإيقاف إفراز الـ SASP المحفز للورم، مع الحرص على ألا تعود الخلية لحالة الإنقسام، يجب أن تظل متوقفة.
وهذا ملخص البحث في صورة:
ننتقل الآن إلى كيفية إجابتهم على الأسئلة التي طُرحت (Method) والنتائج (Results)
____________________________________________________________________________
نوع الخلايا المستخدمة في الدراسة:
استخدم الباحثين خلايا IMR90 ER:RAS وهي عبارة عن خلايا Human primary fibroblast تم إدخال بلازميد داخلها يحمل نسخة طافرة من مستقبل الاستروجين (Estrogen receptor: ER) و البروتين الورمي (RAS (Oncogen protein
الخلية طبيعية، لكن عند إضافة مركب (hydroxy-tamoxifen (4-OHT،يرتبط بمنطقة الـ ER ويُنشِط التعبير الجيني للبروتين RAS باستمرار.
ارتفاع البروتين RAS في الخلية يُحفز عملية الـ Senescence، وهنا نُسمي الحالة هذه: (Oncogen-induced senescence (OIS، لأن البروتين RAS الـ (Oncogen) هو سبب دخول الخلية لحالة الشيخوخة.
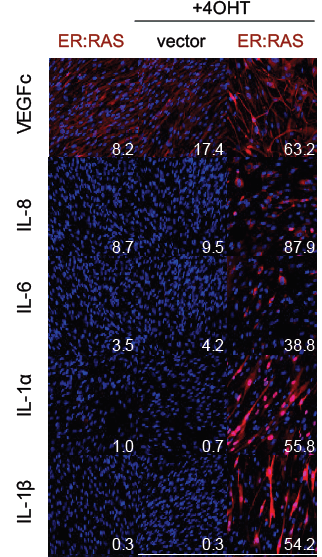
طبعا بعد إضافة 4-OHT للخلية، يجب أن يتأكد الباحثين بعدها من أن الخلية دخلت في حالة الشيخوخة، يتم ذلك عن طريق دراسة التعبير الجيني لأشهر البروتينات الإلتهابية (pro-inflammatory factors) التي تُفرز عادة ضِمن الـ SASP، وهما IL-8 and IL-6، لو دخلت الخلية لحالة الشيخوخة، يرتفع التعبير الجيني لهما.
التأكد من وجودهما يتم بواسطة تكنيكين، على مستوى بروتيني وجزيئي:
-(Immunoflurecence (IF: أجسام مضادة ترتبط بالبروتينات هذه وتعطي لون يتم تصويره بالميكروسكوب الإلكتروني.
-qRT-PCR: استخلاص الـ mRNA من الخلايا لمعرفة كمية الـ mRNA الخاصة بالجينين.
1- التعرف على البروتينات المنظِمة للـ SASP:
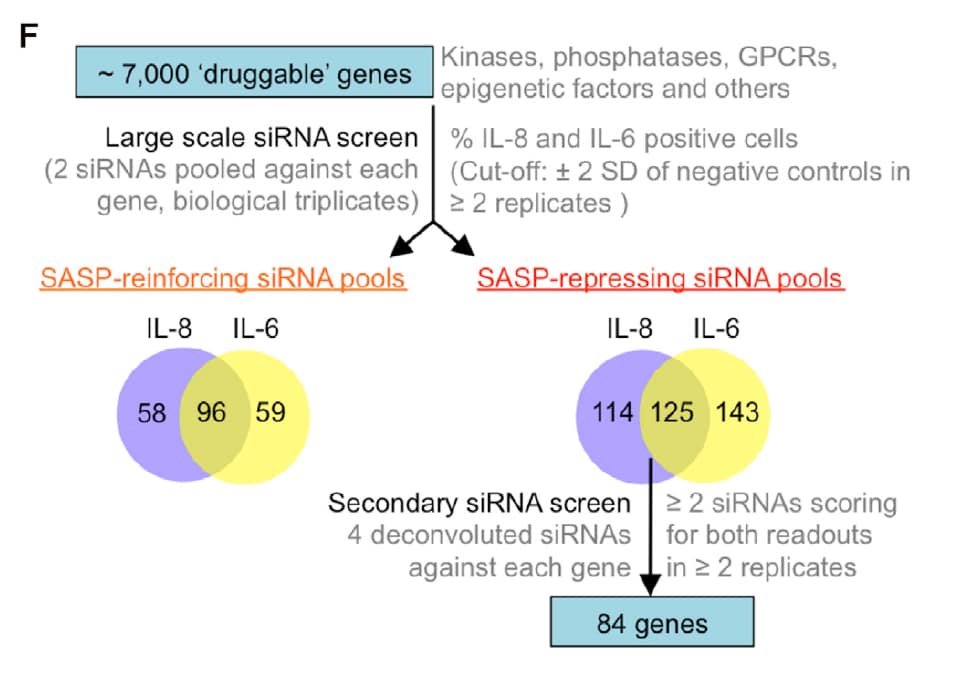
بعد 8 أيام إضافة الـ 4-OHT على الخلايا، ثم التأكد من دخول الخلية لحالة الشيخوخة، رغِب الباحثين أولا بمعرفة البروتينات المنظمة للـ SASP، فقاموا بإجراء مسح كامل لما يسمى بـ druggable genome -هذا مُسمى أُطلق على الجينات الي تُعطي بروتينات بإمكاننا استهدافها عن طريق تصنيع جزيئات صغيرة دوائية، ترتبط بالـ functional domain للبروتين وتوقف عمله-
استهدفوا الجينات هذه (7000) عن طريق إضافة العديد من الـ (small interferon RNA (siRNA (ثنين لكل جين!)، يعملون على تكسير الـ mRNA الخاص بالجين المُنظِم، ثم يقيسون مستوى الـ IL-8 & IL-6 لمعرفة كيف تأثر.
وانتهوا بمعرفة 125 جين، انخفاض التعبير الجيني لهذه الـ 125 جين يقلل مستوى الـ IL-8 & IL-6، مما يعني أن بإمكاننا استهداف أحد هذه الجينات لتقليل الـ SASP.
أعادوا التجربة مرة أخرى، أخذوا الـ 125 جين، واستهدفوها بأربعة siRNAs لكل جين، انتهوا بمعرفة 84 جين، يقل التعبير الجيني لهم مؤديا لإنخفاض IL-8 and IL-6.
لكن القصة ما انتهت هنا، وليست بهذه السهولة.
2- تحديد أي البروتينات المنظِمة تتحكم بالـ SASP دون أن تُحفز إعادة إنقسام الخلية:
مثل ما نعرف، الخلية الهَرِمة تتميز بالوقوف التام عن الإنقسام، ولو عادت تنقسم فإحتمال كبير جدا تتحول لخلية سرطانية، خصوصا لو كانت (Oncogen-induced senescence (OIS كما في حالتنا الآن.
لذلك، لدينا الآن 84 جين نعرف أن إيقافهم يوقف الـ SASP، لكن، هل إيقافهم يوقف الـ SASP لوحدها؟ أم يوقف شيخوخة الخلية (يحفزها للإنقسام من جديد) لذلك لا نجد أثر للـ SASP؟
لذا هدف الباحثين من التجربة الثانية هو معرفة أي الجينات هذه -عند تقليله- يوقف الـ SASP دون إيقاف شيخوخة الخلية، وذلك عن طريق:
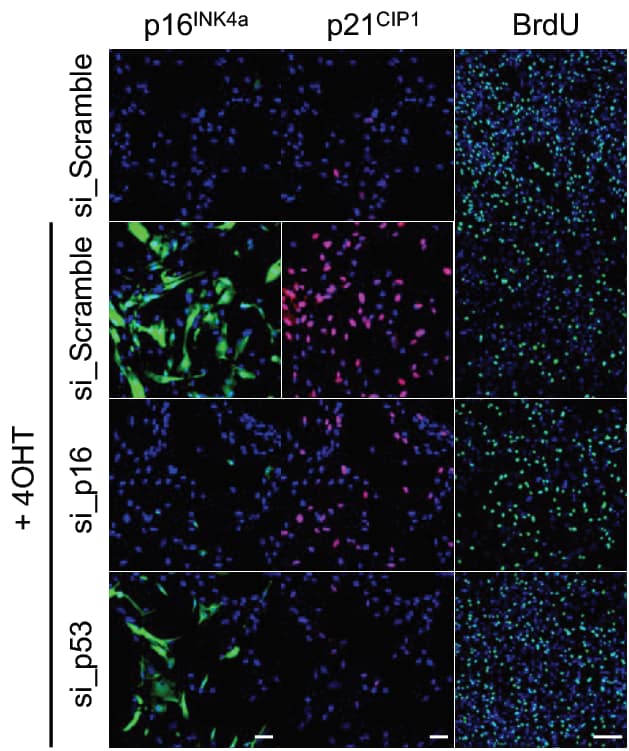
-دراسة التعبير الجيني لاثنين من البروتينات المهمة للإيقاف نمو الخلية، (p16(INK4a) and p21(CIP1. كلا البروتينين يعملان على إيقاف الخلية حتى لا تنتقل من مرحلة G1 إلى S. لذا، لو كان التعبير الجيني لهم عالي = الخلية متوقفة عن النمو، والعكس بالعكس.
-تَتَبُع الـ (bromodeoxyuridine (BrdU، وهو عبارة عن نيوكليوتيد مُصَنَع، شبيه جدا بالـ Thiamin، يتم إضافته للخلايا، فيدخل في تصنيع الـ DNA الجديد (بما أنه شبيه بالثيامين فيتنافس معه ويدخل مكانه)، ونستطيع الكشف عنه عبر أجسام مضادة (antibodies) ترتبط فيه وتعطي flurecence. بتتبعه نتأكد لو الخلايا تنقسم أم لا. لو الخلايا تنقسم فكثافة الـ BrdU تكون عالية “دخل بتصنيع الـ DNA الجديد”، أما لو الخلايا متوقفة (هَرِمة/ مافيه DNA تتصنع) فكثافته قليلة. في الصورة يتضح الفرق:
.
إذن، اللي حصل الآن أنهم أضافوا الـ siRNAs ضد الـ 84 جين مُنظِم على الخلايا الهَرِمة، ثم قاسوا التعبير الجيني لـ p21 & p16، وتتبعوا كثافة الـ BrdU. ليتعرفوا بالنهاية على الجينات التي لا تُسبب إعادة إنقسام الخلية. والنتائج ظهرت كمجموعات (clusters)، كما في الصورة:
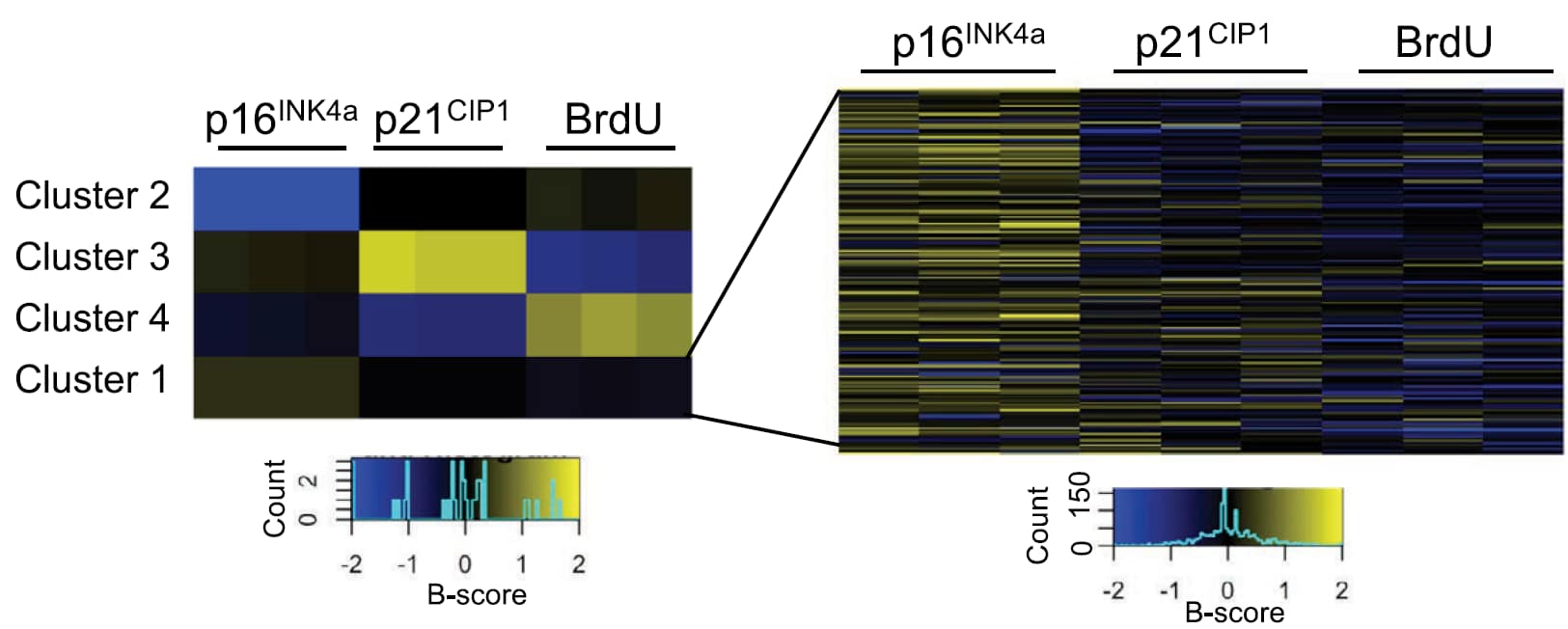
بناء على النتيجة، الجينات المُمنظِمة في cluster1 (عدد 50 جين) هي المناسبة حتى نستهدفها لتقليل الـ SASP و الحفاظ على شيخوخة الخلية في الوقت ذاته.
انتهت هذه المرحلة، والآن من الـ 84 جين لدينا 50 جين يتفقون مع المعايير المطلوبة ويمكننااستهدافهم. ولكن، سؤال جديد يُطرح ويحتاج إلى دراسة، وهو:
استخدم الباحثين IL-8 and IL-6 فقط كمعيار للـ SASP؛ لأن تأثيرهم في نشوء الورم كبير جدا، ولكن، الـ SASP عبارة عن عدد هائل من البروتينات -كما ذكرنا سلفا- لذا، يجب أن ندرسها ولا نقتصر على الـ IL-8 and IL-6.
لذلك، قرر الباحثين عمل تجربة genome-wide transcriptome profiling، ويجب أن تعرفوا أن هذا النوع من التجارب يعتبر حديث -إلى حد ما، ظهرت نُسخ مطورة الآن- وقوي جدا، لأنك تدرس كل الـ mRNA في الخلية! تدرسها قبل وبعد (المؤثر الذي وضعته) وترى كيف اختلف حال الخلية وماهي البروتينات التي تأثرت بهذا المؤثر، والآن تطور إلى Single-cell transcriptomics، وبصراحة، بظهور هذه التقنية، تفقد كل التجارب الأخرى قوتها ودقتها أمامها.
المهم، استهدف الباحثين 38 جين (من أصل 50) بـ siRNAs، وذلك عن طريق إدخال الـ siRNA في الخلايا، ثم بعد فترة استخلصوا كل الـ mRNA الموجود في الخلية، وأدخلوهم في جهاز خاص ليقرأهم ويبين لنا التغير الذي حصل في كل جين، هل ارتفع أم انخفض بعد إضافة الـ siRNA ضد الجينات المنظمة؟ (يعني: بعدما استهدفنا كل جين من الـ 38 جين “اللي نعرف أنهم يتحكمون بالـ SASP بس ما نعرف ايش هم بالضبط”، وش صار في الجينات اللي بالخلية بشكل عام؟ وش الجينات اللي زادت، وهل تعتبر من الـ SASP الضارة؟ ووش الجينات اللي نقصت؟)؟
النتيجة كانت:
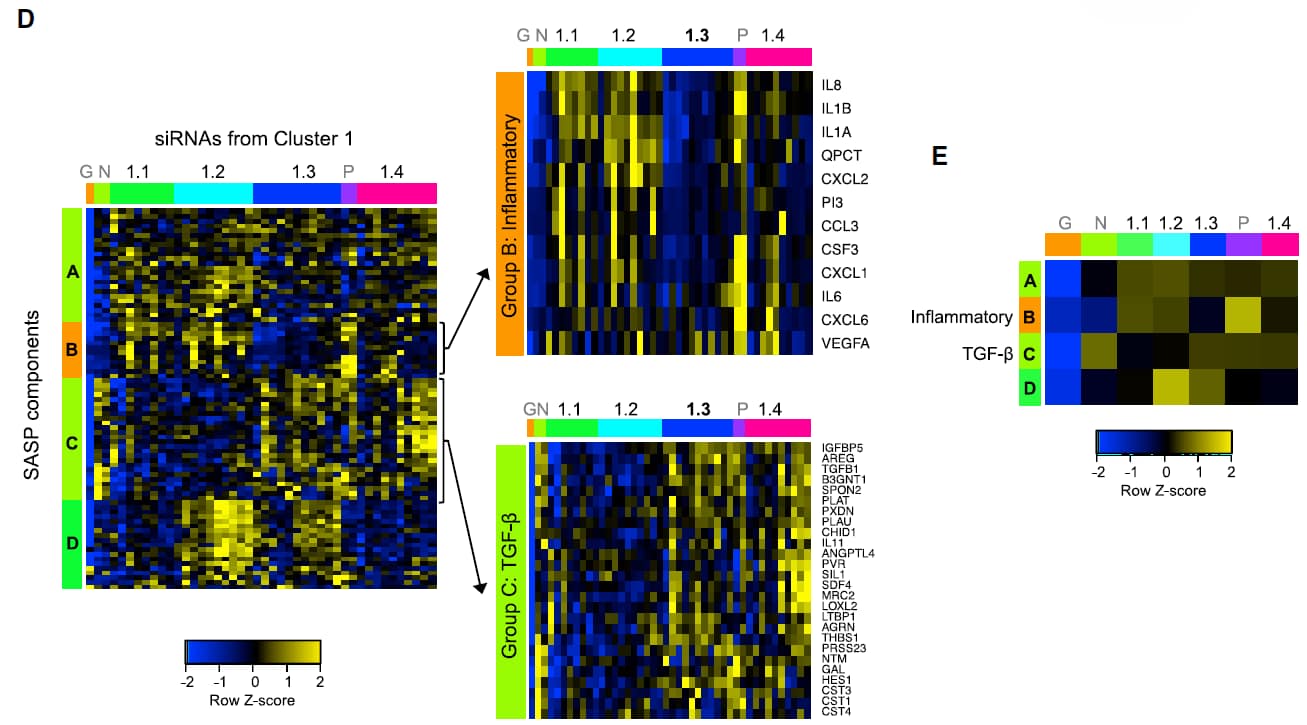
من هذا كله، قرر الباحثين اختيار جين واحد فقط من Cluster 1 and subcluster 1.3 or 1.4 (لم يوضحوا)، وهو الجين PTBP1، وجدوا أن إيقافه يُقلل الـ inflammatory factors بشكل ملحوظ!
لكن، الآن بما أن لديهم جين واحد، يحتاجون لإجراء العديد من الدراسات التأكيدية.
وهذا أضعه في جزء ثاني منفصل إن شاء الله ❤️.
والسلام عليكم ورحمة الله وبركاته.
References:
- Georgilis, A., et al., PTBP1-mediated alternative splicing regulates the inflammatory secretome and the pro-tumorigenic effects of senescent cells. Cancer Cell, 2018. 34(1): p. 85-102. e9.
- Faget, D.V., Q. Ren, and S.A. Stewart, Unmasking senescence: context-dependent effects of SASP in cancer. Nature Reviews Cancer, 2019: p. 1.
- Innes, A.J. and J. Gil, IMR90 ER: RAS: A Cell Model of Oncogene-Induced Senescence, in Cellular Senescence. 2019, Springer. p. 83-92.
- Hopkins, A.L. and C.R. Groom, The druggable genome. Nature reviews Drug discovery, 2002. 1(9): p. 727.

616 رد على “ورقة علمية: PTBP1-Mediated Alternative Splicing Regulates the Inflammatory Secretome and the Pro-tumorigenic Effects of Senescent Cells–PART 1”
Partner with us for high-paying affiliate deals—join now!
Earn passive income on autopilot—become our affiliate!
Become our partner and turn referrals into revenue—join now!
Boost your profits with our affiliate program—apply today!
Join our affiliate community and earn more—register now!
Boost your income—enroll in our affiliate program today!
Earn recurring commissions with each referral—enroll today!
Start earning passive income—join our affiliate network today!
Join our affiliate program and start earning commissions today—sign up now!
Start earning on autopilot—become our affiliate partner!
Earn passive income with every click—sign up today!
Drive sales, earn commissions—apply now!
Boost your profits with our affiliate program—apply today!
Refer customers, collect commissions—join our affiliate program!
Share your link and rake in rewards—join our affiliate team!
Start profiting from your traffic—sign up today!
Promote our brand and get paid—enroll in our affiliate program!
Turn traffic into cash—apply to our affiliate program today!
Earn up to 40% commission per sale—join our affiliate program now!
Join our affiliate community and start earning instantly!
Share your link and rake in rewards—join our affiliate team!
Boost your earnings effortlessly—become our affiliate!
Turn your traffic into cash—join our affiliate program!
Monetize your traffic instantly—enroll in our affiliate network!
Join forces with us and profit from every click!
Get rewarded for every recommendation—join our affiliate network!
Your network, your earnings—apply to our affiliate program now!
Apply now and receive dedicated support for affiliates!
Partner with us and enjoy recurring commission payouts!
Unlock exclusive affiliate perks—register now!
Join our affiliate family and watch your profits soar—sign up today!
Refer and earn up to 50% commission—join now!
Partner with us and earn recurring commissions—join the affiliate program!
Maximize your earnings with top-tier offers—apply now!
Get started instantly—earn on every referral you make!
Share your unique link and earn up to 40% commission!
Start earning passive income—join our affiliate network today!
Get rewarded for every recommendation—join our affiliate network!
Boost your income effortlessly—join our affiliate network now!
Hi https://is.gd/9PLRLO
Hi https://is.gd/9PLRLO
Fast indexing of website pages and backlinks on Google https://is.gd/r7kPlC
Special ability to earn $ASTER bonus https://is.gd/CGTnqR
Claim 5% Rebate and Exclusive Bonuses on AsterDEX https://is.gd/CGTnqR
Enter your invite code to earn your airdrop on Aster https://is.gd/ZceEI6
https://shorturl.fm/7PzZX
https://shorturl.fm/mSPnA
https://shorturl.fm/KRmQc
https://shorturl.fm/1qLIP
https://shorturl.fm/HyD4n
https://shorturl.fm/ud7S0
https://shorturl.fm/G1shf
https://shorturl.fm/NaU4O
https://shorturl.fm/I3563
https://shorturl.fm/owVb8
https://shorturl.fm/CcTMN
https://shorturl.fm/1WT9s
https://shorturl.fm/mvYYn
https://shorturl.fm/E6W0T
https://shorturl.fm/rY9g3
https://shorturl.fm/mvWOW
https://shorturl.fm/Nlg1z
https://shorturl.fm/zLfJs
https://shorturl.fm/juksC
https://shorturl.fm/foSon
https://shorturl.fm/g9c3L
https://shorturl.fm/t3KwX
https://shorturl.fm/4omQa
https://shorturl.fm/b5qCh
https://shorturl.fm/quN4D
https://shorturl.fm/iAnLn
https://shorturl.fm/ymuFw
https://shorturl.fm/Ubu8k
https://shorturl.fm/TLkcy
https://shorturl.fm/mb3TV
https://shorturl.fm/NbA8b
https://shorturl.fm/1SyMn
https://shorturl.fm/5wJ9p
https://shorturl.fm/NAZdD
https://shorturl.fm/U1rP2
https://shorturl.fm/ZCudO
https://shorturl.fm/R5PHY
https://shorturl.fm/NdVZf
https://shorturl.fm/pOjQs
https://shorturl.fm/0A9kG
https://shorturl.fm/rifT2
https://shorturl.fm/tqkdj
https://shorturl.fm/ymUSc
https://shorturl.fm/PNDPY
https://shorturl.fm/y5YaL
https://shorturl.fm/TH6hz
https://shorturl.fm/tJDiX
https://shorturl.fm/06ZoM
https://shorturl.fm/5tg8v
https://shorturl.fm/nzG1m
https://shorturl.fm/O8e7c
https://shorturl.fm/6btBC
https://shorturl.fm/G17uu
https://shorturl.fm/ns9uG
https://shorturl.fm/ixRN9
https://shorturl.fm/Tsdq1
https://shorturl.fm/rOhj7
https://shorturl.fm/B6dLA
https://shorturl.fm/fQwJ1
https://shorturl.fm/XBBDF
https://shorturl.fm/ix3Mc
https://shorturl.fm/cc2ku
https://shorturl.fm/tS7Xc
https://shorturl.fm/vRMTb
https://shorturl.fm/BrOLE
https://shorturl.fm/Aregq
https://shorturl.fm/rJcek
https://shorturl.fm/ZbJiS
https://shorturl.fm/lAkNj
https://shorturl.fm/nVHLV
https://shorturl.fm/2ysGJ
https://shorturl.fm/uuXD8
https://shorturl.fm/ycxX6
https://shorturl.fm/OLY7v
https://shorturl.fm/yeljx
https://shorturl.fm/sVfGo
https://shorturl.fm/NGbdo
https://shorturl.fm/DuDIc
https://shorturl.fm/dFacS
https://shorturl.fm/27S1k
https://shorturl.fm/orAWZ
https://shorturl.fm/jrZc1
https://shorturl.fm/A6JX3
https://shorturl.fm/mzBpq
https://shorturl.fm/cwviE
https://shorturl.fm/F4dV9
https://shorturl.fm/hQ4L6
https://shorturl.fm/U3WE6
https://shorturl.fm/k6pZe
https://shorturl.fm/0PY6E
https://shorturl.fm/VM4ya
https://shorturl.fm/L9vFJ
https://shorturl.fm/Pdk8T
https://shorturl.fm/w5EFR
https://shorturl.fm/LaSrp
https://shorturl.fm/j6371
https://shorturl.fm/JRGci
https://shorturl.fm/U9Yac
https://shorturl.fm/UbqaM
https://shorturl.fm/bRtBH
https://shorturl.fm/UWDm6
https://shorturl.fm/XCbzY
https://shorturl.fm/bMBzc
https://shorturl.fm/K3JAq
https://shorturl.fm/oGtMk
https://shorturl.fm/dexI1
https://shorturl.fm/ytnsz
https://shorturl.fm/lzQrA
https://shorturl.fm/GiWua
https://shorturl.fm/GUeZx
https://shorturl.fm/0tKGd
https://shorturl.fm/Z9DyM
https://shorturl.fm/1mb8H
https://shorturl.fm/2wuoT
https://shorturl.fm/KA4eZ
https://shorturl.fm/Dzbqp
https://shorturl.fm/ZtDYh
https://shorturl.fm/zlafM
https://shorturl.fm/cPZ8c
https://shorturl.fm/PF6AD
https://shorturl.fm/0G7RQ
https://shorturl.fm/96ble
https://shorturl.fm/0rrs2
https://shorturl.fm/UctGR
https://shorturl.fm/Gzq1i
https://shorturl.fm/mEcXK
https://shorturl.fm/8vUmW
https://shorturl.fm/TiCJn
https://shorturl.fm/Jw3DT
https://shorturl.fm/aJ79H
https://shorturl.fm/Rc0Qw
https://shorturl.fm/r7wZ5
https://shorturl.fm/WZVbS
https://shorturl.fm/ScLvr
https://shorturl.fm/s6pzn
https://shorturl.fm/Mxy6M
https://shorturl.fm/mOukW
https://shorturl.fm/enp0S
https://shorturl.fm/uLK2Y
https://shorturl.fm/1UJ7m
https://shorturl.fm/dt0XV
https://shorturl.fm/4yHzw
https://shorturl.fm/b3CVu
https://shorturl.fm/Wrxan
https://shorturl.fm/xWa6G
https://shorturl.fm/w1vfr
https://shorturl.fm/h0J6l
https://shorturl.fm/xwHN9
https://shorturl.fm/aYjBT
https://shorturl.fm/Ab9IP
https://shorturl.fm/6nrQ8
https://shorturl.fm/0jVc5
https://shorturl.fm/m8CmF
https://shorturl.fm/fUQcv
https://shorturl.fm/mq1oS
https://shorturl.fm/TLya3
https://shorturl.fm/ukE0O
https://shorturl.fm/iqLOU
https://shorturl.fm/6bPvI
https://shorturl.fm/IOwxw
https://shorturl.fm/SPwXx
https://shorturl.fm/oAFi2
https://shorturl.fm/l7jCw
https://shorturl.fm/wg8iQ
https://shorturl.fm/rpT6q
https://shorturl.fm/FzJhB
https://shorturl.fm/IJjaM
https://shorturl.fm/DX5yQ
https://shorturl.fm/rWbJe
https://shorturl.fm/W50BX
https://shorturl.fm/l77fS
https://shorturl.fm/fa2VO
https://shorturl.fm/RVXHo
https://shorturl.fm/dbZKy
https://shorturl.fm/ZlqWd
https://shorturl.fm/fgt1r
https://shorturl.fm/K5ycG
https://shorturl.fm/0pM0w
https://shorturl.fm/PbY9T
https://shorturl.fm/exOKm
https://shorturl.fm/0hYqr
https://shorturl.fm/YGOJq
https://shorturl.fm/GcjuG
https://shorturl.fm/vB1sV
https://shorturl.fm/GIICT
https://shorturl.fm/jKd0W
https://shorturl.fm/ntd7Q
https://shorturl.fm/oE8oh
https://shorturl.fm/lZj2p
https://shorturl.fm/dS0nY
https://shorturl.fm/RcFA7
https://shorturl.fm/7ZaPr
https://shorturl.fm/hLxcc
https://shorturl.fm/faG5m
https://shorturl.fm/pqsYb
https://shorturl.fm/YlMNH
https://shorturl.fm/VUQWY
https://shorturl.fm/k3vSj
https://shorturl.fm/4xpJ1
https://shorturl.fm/1GNdf
https://shorturl.fm/d6FAX
https://shorturl.fm/lsrnF
https://shorturl.fm/lZu24
https://shorturl.fm/97YvY
https://shorturl.fm/CiOJZ
https://shorturl.fm/hVBtQ
https://shorturl.fm/V7Aal
https://shorturl.fm/9Anz4
https://shorturl.fm/3nLHW
https://shorturl.fm/UTBko
https://shorturl.fm/X4tgG
https://shorturl.fm/IVdeS
https://shorturl.fm/4TCSe
https://shorturl.fm/DiCYj
https://shorturl.fm/erTvh
https://shorturl.fm/mzMqe
https://shorturl.fm/USrhK
https://shorturl.fm/USrhK
https://shorturl.fm/rOWdi
https://shorturl.fm/QBbTr
https://shorturl.fm/Z8FFW
https://shorturl.fm/4QFqE
https://shorturl.fm/ohD2d
https://shorturl.fm/eolsM
https://shorturl.fm/pFEoL
https://shorturl.fm/qIrdG
https://shorturl.fm/Ov7NP
https://shorturl.fm/1T7Hb
https://shorturl.fm/K5YgT
https://shorturl.fm/cZntz
https://shorturl.fm/HJlvc
https://shorturl.fm/Rlr8p
https://shorturl.fm/YUvsx
https://shorturl.fm/rd6d3
https://shorturl.fm/U9I8E
https://shorturl.fm/Mznsu
https://shorturl.fm/jOxe8
https://shorturl.fm/ixW5Z
https://shorturl.fm/PwJUv
https://shorturl.fm/I2mYu
https://shorturl.fm/neyZK
https://shorturl.fm/wi6sb
https://shorturl.fm/4tzCJ
https://shorturl.fm/uZz2S
https://shorturl.fm/LJYKB
https://shorturl.fm/rCyrz
https://shorturl.fm/Yvkee
https://shorturl.fm/GcIaA
https://shorturl.fm/GMJoY
https://shorturl.fm/ZspcU
https://shorturl.fm/DnDQt
https://shorturl.fm/3mKz2
https://shorturl.fm/e2Ao7
https://shorturl.fm/r7Xfz
https://shorturl.fm/e2lpD
https://shorturl.fm/IeZBM
https://shorturl.fm/d2ePe
https://shorturl.fm/gth2w
https://shorturl.fm/9SSOO
https://shorturl.fm/ry2ZV
https://shorturl.fm/3tBeN
https://shorturl.fm/QznAb
https://shorturl.fm/Z9aZA
https://shorturl.fm/Ivsa5
https://shorturl.fm/wkpOM
https://shorturl.fm/paBCq
https://shorturl.fm/RcvaU
https://shorturl.fm/A4yin
https://shorturl.fm/nw2If
https://shorturl.fm/boPsz
https://shorturl.fm/XJ2dm
https://shorturl.fm/aFjcV
https://shorturl.fm/uex04
https://shorturl.fm/dZEkY
https://shorturl.fm/eHsRu
https://shorturl.fm/xNTne
https://shorturl.fm/Z6S3e
https://shorturl.fm/TUOpt
https://shorturl.fm/sw03t
https://shorturl.fm/fchW5
https://shorturl.fm/innGf
https://shorturl.fm/QDwPt
https://shorturl.fm/QSo0I
https://shorturl.fm/fX0uW
https://shorturl.fm/2Vu6Z
https://shorturl.fm/2MbSA
https://shorturl.fm/2BVOk
https://shorturl.fm/xo8bq
https://shorturl.fm/Ut9pQ
https://shorturl.fm/Bl6fR
https://shorturl.fm/FKQia
https://shorturl.fm/ba1kj
https://shorturl.fm/7g10f
https://shorturl.fm/NRfFK
https://shorturl.fm/o9C2L
https://shorturl.fm/ADUT8
https://shorturl.fm/qNDkM
https://shorturl.fm/q53UL
https://shorturl.fm/DpmKU
https://shorturl.fm/gfUdd
https://shorturl.fm/cQEB8
https://shorturl.fm/tG5Hh
https://shorturl.fm/aiRTk
https://shorturl.fm/pXjuI
https://shorturl.fm/Khl14
https://shorturl.fm/4XMRB
https://shorturl.fm/Qo6MX
https://shorturl.fm/bCoOP
https://shorturl.fm/aJlIt
https://shorturl.fm/bdnA9
https://shorturl.fm/v7xdX
https://shorturl.fm/wG9Au
https://shorturl.fm/msgBF
https://shorturl.fm/ghKkn
https://shorturl.fm/IxMeQ
https://shorturl.fm/ftR3u
https://shorturl.fm/0G1pd
https://shorturl.fm/ZP4gp
https://shorturl.fm/tVZQu
https://shorturl.fm/LBA2Y
https://shorturl.fm/NfQdE
https://shorturl.fm/LEHHf
https://shorturl.fm/rgAMv
https://shorturl.fm/Ogtex
https://shorturl.fm/w6z6r
https://shorturl.fm/zodK6
https://shorturl.fm/6ruEL
https://shorturl.fm/1u53L
https://shorturl.fm/gf94Q
https://shorturl.fm/xVIea
https://shorturl.fm/3xqoN
https://shorturl.fm/6tJuM
https://shorturl.fm/7BUq1
https://shorturl.fm/58dIs
https://shorturl.fm/lCE51
https://shorturl.fm/73csK
https://shorturl.fm/6YroI
https://shorturl.fm/y1DeA
https://shorturl.fm/G2k1w
https://shorturl.fm/r2Dw0
https://shorturl.fm/COFpa
https://shorturl.fm/I5EmT
https://shorturl.fm/64NP6
https://shorturl.fm/Tvb1O
https://shorturl.fm/m0JxY
https://shorturl.fm/RQMAy
https://shorturl.fm/5uzt5
https://shorturl.fm/3swkO
https://shorturl.fm/sLrGF
https://shorturl.fm/PbmS3
https://shorturl.fm/wMtVg
https://shorturl.fm/AOxvB
https://shorturl.fm/QPbi2
https://shorturl.fm/Z79Wn
https://shorturl.fm/0NSkA
https://shorturl.fm/jPoVI
https://shorturl.fm/UJWKs
https://shorturl.fm/6kPfU
https://shorturl.fm/61XnS
https://shorturl.fm/Ulr58
https://shorturl.fm/PZcb8
https://shorturl.fm/bVk1d
https://shorturl.fm/eucvH
https://shorturl.fm/Gc3bA
https://shorturl.fm/ESiwc
https://shorturl.fm/lCab0
https://shorturl.fm/DPlKf
achetez kamagra le lendemain, commande de livraison fedex le lendemain kamagra cod
kamagra acheter fedex
není nutný předpis kamagra
kupte si kamagra bez lékařského předpisu
how to buy itraconazole uk suppliers
how to get a prescription for itraconazole
how to order fildena mastercard buy
cheapest buy fildena generic efficacy
buying gabapentin american express canada
cheap gabapentin american pharmacy
https://shorturl.fm/vARd8
buy cheap flexeril cyclobenzaprine australia online no prescription
online order flexeril cyclobenzaprine uk generic
buy dutasteride cheap store
ordering dutasteride purchase online safely
online order dutasteride price in canada
cheap dutasteride cheap real
avodart canada prescription
how to order avodart generic work
order staxyn generic how effective
buy generic staxyn online from canada
https://shorturl.fm/wKhby
buy xifaxan purchase in canada
ordering xifaxan generic tablets
pictures of rifaximin drug labels
buying rifaximin cheap with prescription
https://shorturl.fm/JB8Ox
https://shorturl.fm/UEm4B
cheapest buy enclomiphene usa buy online
get enclomiphene generic ingredients
online order androxal cheap store
cheap androxal by money order
https://shorturl.fm/h0Eo1
https://shorturl.fm/W11CN
https://shorturl.fm/RsERO
https://shorturl.fm/4tE2n
https://shorturl.fm/SpcZa
https://shorturl.fm/VnHCo
https://shorturl.fm/HhMwY
https://shorturl.fm/GgwwC
https://shorturl.fm/Xc10J
https://shorturl.fm/XMbDu
https://shorturl.fm/vKJdv
https://shorturl.fm/2WYHC
https://shorturl.fm/PjLdU
https://shorturl.fm/yBxDm
https://shorturl.fm/9JJTj
https://shorturl.fm/ogrlX
https://shorturl.fm/Z6Nai
https://shorturl.fm/MEDye
https://shorturl.fm/o4mqa
https://shorturl.fm/oUkUG
https://shorturl.fm/KLzAV
https://shorturl.fm/Gwj2B
https://shorturl.fm/WI8Vj
https://shorturl.fm/XRbqb
https://shorturl.fm/GkTtZ
https://shorturl.fm/ySo4o
https://shorturl.fm/vASAS
https://shorturl.fm/y0oOV
https://shorturl.fm/Ia5b0
https://shorturl.fm/TjFhe
https://shorturl.fm/vONr0
https://shorturl.fm/A41y2
https://shorturl.fm/Qr2n9
https://shorturl.fm/ntZwD
https://shorturl.fm/izd5x
https://shorturl.fm/dS6CZ
https://shorturl.fm/rUFWm
https://shorturl.fm/aPD1X
https://shorturl.fm/b5ozc
https://shorturl.fm/Rqhg6
https://shorturl.fm/Hq6rV
https://shorturl.fm/iUlQ9
https://shorturl.fm/RG16m
https://shorturl.fm/SV8Vz
https://shorturl.fm/nXfCa
https://shorturl.fm/tLwRo
https://shorturl.fm/FdXjx
https://shorturl.fm/87wcT
https://shorturl.fm/wkQEu
https://shorturl.fm/KCOUO
https://shorturl.fm/0fOl9
https://shorturl.fm/3mvBX
https://shorturl.fm/6bBOW
https://shorturl.fm/TApsA
https://shorturl.fm/rSrnU
https://shorturl.fm/yayx8
https://shorturl.fm/autZ0
https://shorturl.fm/6tnNh
https://shorturl.fm/8RzbU
https://shorturl.fm/Bouto
https://shorturl.fm/p7dTe
https://shorturl.fm/TGIx8
https://shorturl.fm/Px48s
https://shorturl.fm/DNUnh
https://shorturl.fm/ZWYHN
https://shorturl.fm/qroP5
https://shorturl.fm/CegKR
https://shorturl.fm/xoBt6
https://shorturl.fm/ZxQm9
https://shorturl.fm/WV4ud
https://shorturl.fm/RPoAK
https://shorturl.fm/y23lF
https://shorturl.fm/f6Tt8
https://shorturl.fm/fyff5
https://shorturl.fm/9v47u
https://shorturl.fm/egZvR
https://shorturl.fm/KCu6Y
https://shorturl.fm/0bj3T
https://shorturl.fm/Dk2xs
https://shorturl.fm/xoeDz
https://shorturl.fm/8XsRx
https://shorturl.fm/VYur7
https://shorturl.fm/mMUY0
https://shorturl.fm/4rQdN
https://shorturl.fm/8xhd8
https://shorturl.fm/FoaD3
https://shorturl.fm/EAUWD
https://shorturl.fm/Wm4Yl
https://shorturl.fm/y1yV6
https://shorturl.fm/vaHUc
https://shorturl.fm/XK7oV
https://shorturl.fm/plSeC
https://shorturl.fm/p7OHS
https://shorturl.fm/l1goD
https://shorturl.fm/DL1Km
https://shorturl.fm/ROycg
Promote our products and earn real money—apply today! https://shorturl.fm/77xNT
Share our products, earn up to 40% per sale—apply today! https://shorturl.fm/CAvk7
Share your unique link and earn up to 40% commission! https://shorturl.fm/mRAUY
Join our affiliate community and earn more—register now! https://shorturl.fm/Gc7SE
Earn passive income on autopilot—become our affiliate! https://shorturl.fm/5oiNL
Join our affiliate program and start earning commissions today—sign up now! https://shorturl.fm/FSglH
Unlock top-tier commissions—become our affiliate partner now! https://shorturl.fm/iKDnE
Earn big by sharing our offers—become an affiliate today! https://shorturl.fm/B2zLU
Maximize your income with our high-converting offers—join as an affiliate! https://shorturl.fm/8gctp
Start earning on every sale—become our affiliate partner today! https://shorturl.fm/mSkTs
Unlock exclusive rewards with every referral—apply to our affiliate program now! https://shorturl.fm/UIJu1
Partner with us and enjoy high payouts—apply now! https://shorturl.fm/DK4ig
Join our affiliate community and earn more—register now! https://shorturl.fm/jS0zr
Monetize your audience—become an affiliate partner now! https://shorturl.fm/HnOwx
Tap into unlimited earnings—sign up for our affiliate program! https://shorturl.fm/xU1E1
Start earning passive income—become our affiliate partner! https://shorturl.fm/S94dC
Drive sales, collect commissions—join our affiliate team! https://shorturl.fm/6kDap
Maximize your earnings with top-tier offers—apply now! https://shorturl.fm/08KQk
Promote our products and earn real money—apply today! https://shorturl.fm/LC8eU
Share our link, earn real money—signup for our affiliate program! https://shorturl.fm/kk3DS
Earn up to 40% commission per sale—join our affiliate program now! https://shorturl.fm/odhz7
Promote our products—get paid for every sale you generate! https://shorturl.fm/4eMNB
Join our affiliate program today and start earning up to 30% commission—sign up now! https://shorturl.fm/egS9p
Boost your profits with our affiliate program—apply today! https://shorturl.fm/eritL
Sign up and turn your connections into cash—join our affiliate program! https://shorturl.fm/vrrcJ
Boost your profits with our affiliate program—apply today! https://shorturl.fm/OFPVn
Join our affiliate program today and earn generous commissions! https://shorturl.fm/PeAPn
Join our affiliate community and maximize your profits—sign up now! https://shorturl.fm/p3Qm9
Turn your network into income—apply to our affiliate program! https://shorturl.fm/m5wtt
Start sharing our link and start earning today! https://shorturl.fm/rmxAL
Sign up and turn your connections into cash—join our affiliate program! https://shorturl.fm/yhDwz
Turn referrals into revenue—sign up for our affiliate program today! https://shorturl.fm/hnoQp
Earn up to 40% commission per sale—join our affiliate program now! https://shorturl.fm/4Ll9E
Become our partner and turn referrals into revenue—join now! https://shorturl.fm/tGaHo
Get rewarded for every recommendation—join our affiliate network! https://shorturl.fm/nVnLm
Boost your earnings effortlessly—become our affiliate! https://shorturl.fm/c0YDm
Start sharing, start earning—become our affiliate today! https://shorturl.fm/IhCFD
Turn your audience into earnings—become an affiliate partner today! https://shorturl.fm/R9DIG
Your influence, your income—join our affiliate network today! https://shorturl.fm/ksuuH
Earn big by sharing our offers—become an affiliate today! https://shorturl.fm/3zqSk
Boost your income effortlessly—join our affiliate network now! https://shorturl.fm/Rbmdw
Get started instantly—earn on every referral you make! https://shorturl.fm/gMbFS
Turn your network into income—apply to our affiliate program! https://shorturl.fm/vLVyO
https://shorturl.fm/DA3HU
https://shorturl.fm/eAlmd
https://shorturl.fm/fSv4z
https://shorturl.fm/Kp34g
https://shorturl.fm/Kp34g
https://shorturl.fm/fSv4z
https://shorturl.fm/VeYJe
https://shorturl.fm/retLL
https://shorturl.fm/JtG9d
https://shorturl.fm/Kp34g
https://shorturl.fm/A5ni8
https://shorturl.fm/oYjg5
https://shorturl.fm/5JO3e
https://shorturl.fm/XIZGD
https://shorturl.fm/5JO3e
https://shorturl.fm/68Y8V
https://shorturl.fm/FIJkD
https://shorturl.fm/XIZGD
https://shorturl.fm/5JO3e
https://shorturl.fm/9fnIC
https://shorturl.fm/6539m
https://shorturl.fm/XIZGD
https://shorturl.fm/68Y8V
https://shorturl.fm/N6nl1
https://shorturl.fm/68Y8V
https://shorturl.fm/TbTre
https://shorturl.fm/TbTre
https://shorturl.fm/FIJkD
Good https://shorturl.fm/TbTre
Super https://shorturl.fm/6539m
Very good partnership https://shorturl.fm/68Y8V
Super https://shorturl.fm/6539m
Awesome https://shorturl.fm/5JO3e
Good partner program https://shorturl.fm/m8ueY
Good https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Good https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Very good https://is.gd/N1ikS2
Awesome https://shorturl.at/2breu
http://wish-club.ru/forums/index.php?autocom=gallery&req=si&img=5233
أعجبني الأسلوب، مشوق وسلس جدًا، وكأنني أسمع صوت إنسان شغوف بما يفعل وأنا اقرأ. كل التوفيق.
Thank you Aljawharah, glad you read it, and I hope you feel the same for the remaining parts 💛
[…] ورقة علمية: PTBP1-Mediated Alternative Splicing Regulates the Inflammatory Secretome and th… […]
[…] ورقة علمية: PTBP1-Mediated Alternative Splicing Regulates the Inflammatory Secretome and th… […]