بسم الله الرحمن الرحيم
بإذن الله في هذه التدوينة سأتحدث عن كيفية التعامل مع النظام المرافق لجهاز QuantStudio 3 Real-Time PCR، الجهاز اللي عملت عليه كان هذا:

Software v1.5.0
في البداية، غالبا لن يستفيد من هذه التدوينة إلا اللي من يعىف فكرة عمل الـ RT-qPCR -سأشرحها بشكل بسيط جدا-، ومن عنده هذا الجهاز في المعمل. وطبعا أنصحكم أولًا بتحميل الـ software على أجهزتكم الشخصية حتى تطبقون عليه بأريحية. ممكن تحميله من هنا:
الجهاز يعتبر من أحدث أجهزة الـ RT-PCR ومن أفضلها حسب تجارب كثير من الباحثين في المعمل، ومع ذكر خواص الجهاز سيتضح لكم السبب.
بعد فتح البرنامج، لو لديك ملف سابق استخرجته من الجهاز ممكن تفتحه، أو نضغط Creat New Experiment.
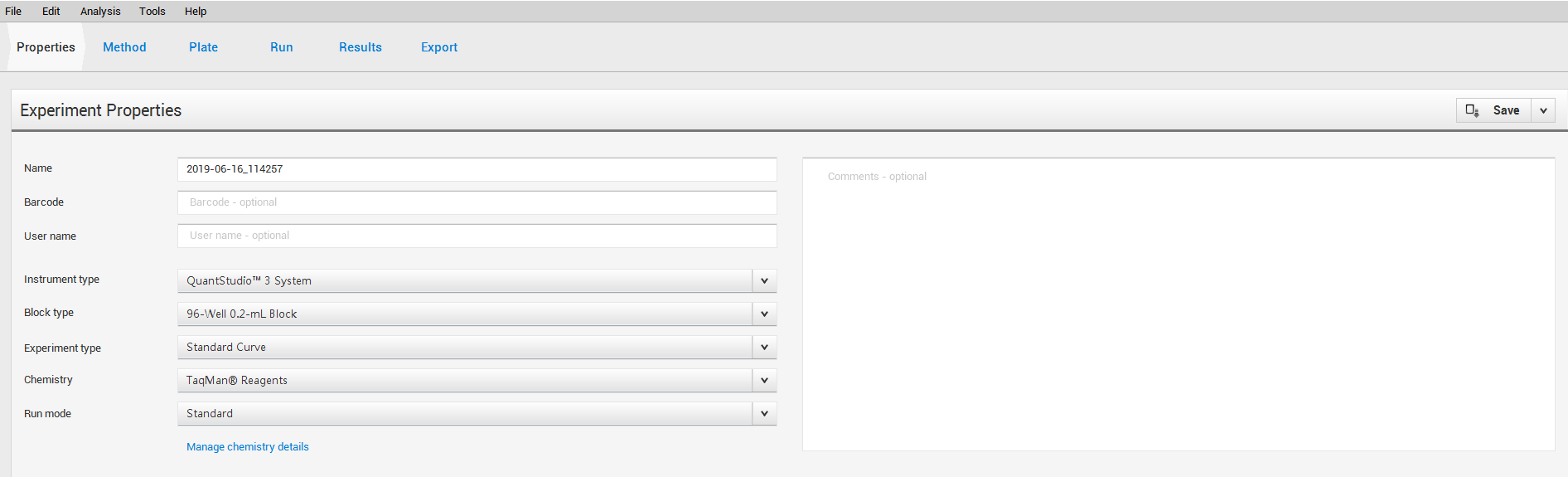
Instrument type: الجهاز اللي عندنا كان QuantStudioTM3 System.
Block type: Depend on the type of plate you use.
-> When we were working on it and use 0.1-mL Block, a warning appears on the instrument says: QuantStudioTM3 System only matches with 96-Well 0.2-mL Block. However, the instructions on the handbook didn’t say that, use 0.2mL to avoid that anyway!
Experiment type: هنا منبع الإبداع في هذا الجهاز، كثير تجارب ممكن تتسوى فيه، وحتى تقدر تصمم تجربتك الخاصة! في الكتاب اللي يجي مع الجهاز -وممكن تحمله من الموقع، راح أرفقه بالأخير- مشروحة .كل تجربة وكيف ممكن تسويها وايش تحتاج
اشتغلت فقط على Comparative Ct، وهي اللي بستفيض بشرحها إن شاء الله.
Chemistry: يعتمد على نوع الـ Primers الخاصة فيك، هل هي مصممة لتتماشى مع نوع SYBR® Green أم TaqMan ® Reagents. فيديو جميل يشرح الفرق بينهم :
__________________________________________________
الآن، لو نوع التجربة لديك هو: (Comparative Ct (∆∆Ct، فالآن راح نتكلم فيها باستفاضة أكبر قبل الإنتقال للجزئية التالية:
الهدف الرئيسي منها هو المقارنة بين التعبير الجيني (مستوى الـ mRNA) للجين/ـات مقارنة بمرجع جيني واحد.
كيف؟ وماهو المرجع الجيني (Reference gene)؟ *يسمى أيضا (House-keeping gene)*
لنفترض أن عندنا الجين P53 ونحب نعرف هل ارتفع التعبير الجيني له في الخلايا السرطانية (ب) أم لا.
وقتها لازم تكون عيناتي:
-خلايا سرطانية (ب) أضع معها البرايمر الخاص بجين P53.
-خلايا طبيعية من نفس المريض مع برايمر P53 حتى أعرف مستوى الجين فيها، وأقارنهم ببعض (عينة مرجعية).
-خلايا سرطانية (ب) أضع معها البرايمر الخاص بـ Reference gene وهو عبارة عن جين يحدث له تعبير (expression) في كل أنواع الخلايا وبنفس المستوى تقريبا، والتعبير الجيني له ما يتأثر بأي حال (حتى كون الخلية سرطانية، ما يأثر على مستوى التعبير الجيني له).
-خلايا طبيعية من نفس المريض مع البرايمر الخاص بالـ Reference gene.
عادة يكون الـجين المرجعي إما: GAPDH or b-Actin.
طبعا الجهاز بيحسب عدد الـ mRNA لكل الجينات المحددة في العينات الأربع، ويقارنهم ببعض، ووقتها يعطيك النتيجة: هل الـ P53 كان مرتفع في الخلايا السرطانية مقارنة بالخلايا الطبيعية (كلها تعتمد على مستوى الـ Reference gene). الفكرة مب معقدة أبدا، لكن من الصعب شرحها بالكلمات، لذلك هذا الفيديو قد يساعد:
والـ HandBook اللي بضيفه بالأخير بيساعدكم أكثر وبشكل أفضل وأوضح.
_______________________________________________
ننتقل الآن لقسم الـ Method:
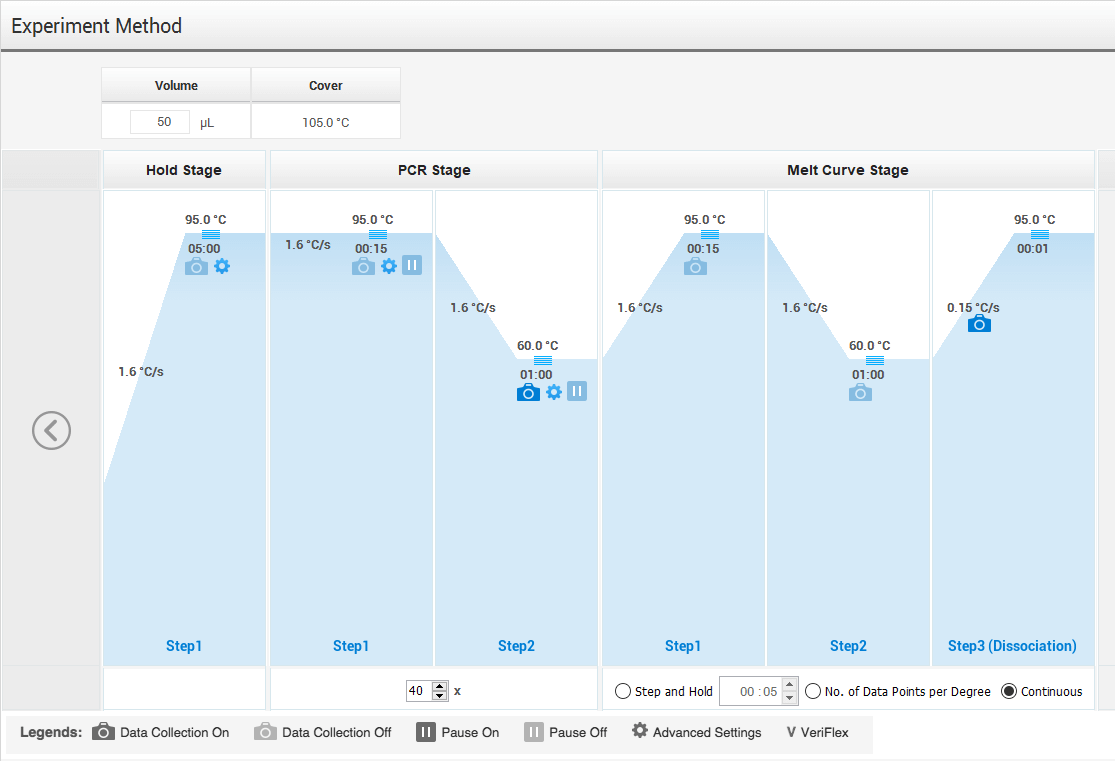
في هذا القسم اتبعوا البروتوكول الخاص فيكم بدقة، ولاتنسوا تغيير القيمة في خانة الـ Volume “كثير ينسونها وهي مهمة جدا”.
أولا، الـ Hold stage، أدخلوا درجة الحرار والزمن. وغالبا تكون خطوة وحدة.
في الـ PCR stage، مهم نتطرق للرموز الموجودة:
رمز الكاميرا: يعني أنه خلال هذه الخطوة سيتم تسجيل البيانات، نحتاجها فقط في الخطوة الثانية (Annealing step).
رمز الإعدادات: لو ضغطتوا عليه راح تنفتح أيقونة فيها الخيارات التالية:
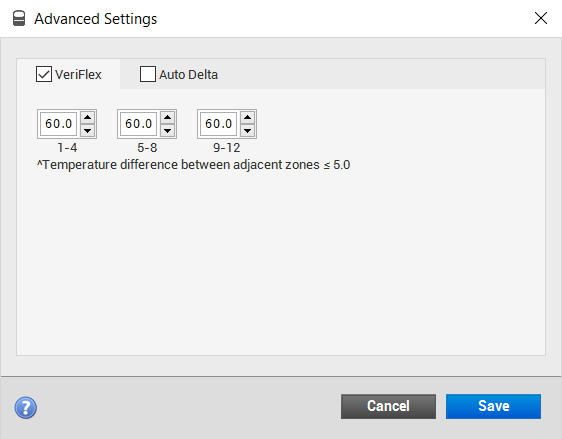
أحسن شيء في هذا الجهاز هو خيار الـ VeriFlex
كما نعرف، الـ Annealing يحصل عند درجة حرارة مختلفة من برايمر لآخر، حسب تصميمنا للبرايمر، وحسب ظروف المعمل اللي نشتغل فيه، وعادة نحتاج نسوي optemaization للبرايمر حتى نعرف عند أي درجة حرارة يسوي Annealing -حتى لو كنا مصممينه بشكل جيد، ضروري نتأكد بالمعمل-.
وبما أننا نستخدم 96-Well plate فنقدر نسوي أكثر من عينة وأكثر من برايمر في نفس الـ plate، للأسف، الأجهزة القديمة ما تقدر تشتغل إلا على درجة حرارة Annealing وحدة، وبالتالي نضطر نسوي برايمر واحد كل مرة، ونخسر plates ووقت.
خيار الـ VeriFlex هنا يسمح لنا بوضع أكثر من درجة حرارة Annealing ! ثلاث درجات حرارة كحد أقصى.
لو تلاحظون، مكتوب 1-4، 5-9،8-12، وهذا يعني أن الـ Wells من 1-4 (First zone) تمشي عليها درجة حرارة واحدة، ومن 5-8 (Second zone) درجة حرارة ثانية، ومن 9-12 (Third zone) درجة حرارة ثالثة، بشرط ألا يتجاوز الفرق بين درجة حرارة الـ Zones المتجاور 5 درجات. WOW
نجي للـ Auto Delta:
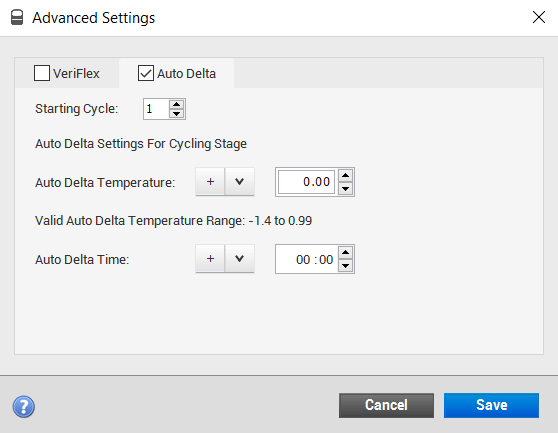
هذا الخيار يسمح لك بتغيير درجة الحرارة بعد مدة معينة، مثلا بعد الـ cycle الـ 20، ممكن تزيد أو تنقص درجة الحرارة -بحدود مذكورة بالصورة- وأيضا ممكن تغير بالوقت.
طبعا هذه الحركة ممكن تساعدنا نسوي touch-down بحيث نمرر أكثر من درجة حرارة على العينة.
ننتقل الآن للـ Melt-Curve Stage:
في حال ما كنت ترغب بالإحتفاظ بالعينة، فهذه المرحلة مهمة جدا جدا جدا -حتى لو ما ذكرت في البروتوكول الخاص فيك- ضروري إضافتها بالأخير، لأنها راح تعطيني نتائج الـ Melting Curve واللي بواسطتها أعرف هل عينتي نقية أم فيها Contamination or primer-dimer ؟ وبدون هذه النتيجة، ماراح أبدا تتأكد بثقة من دقة وسلامة نتائجك.
أنا أخلي إعداداتها كما هي دون تغيير.
إذا انتهيت لاتنسى تضغط Save حتى مايروح شغلك. والآن ننتقل للقسم الثالث.
________________________________________
قسم الـ Plate:
هنا نبدأ نكتب بيانات كل well عشان يقرأها لنا ويحللها، هذا القسم مرن وممكن تغير البيانات المُسجلة فيه حتى بعدما تطلع النتائج.
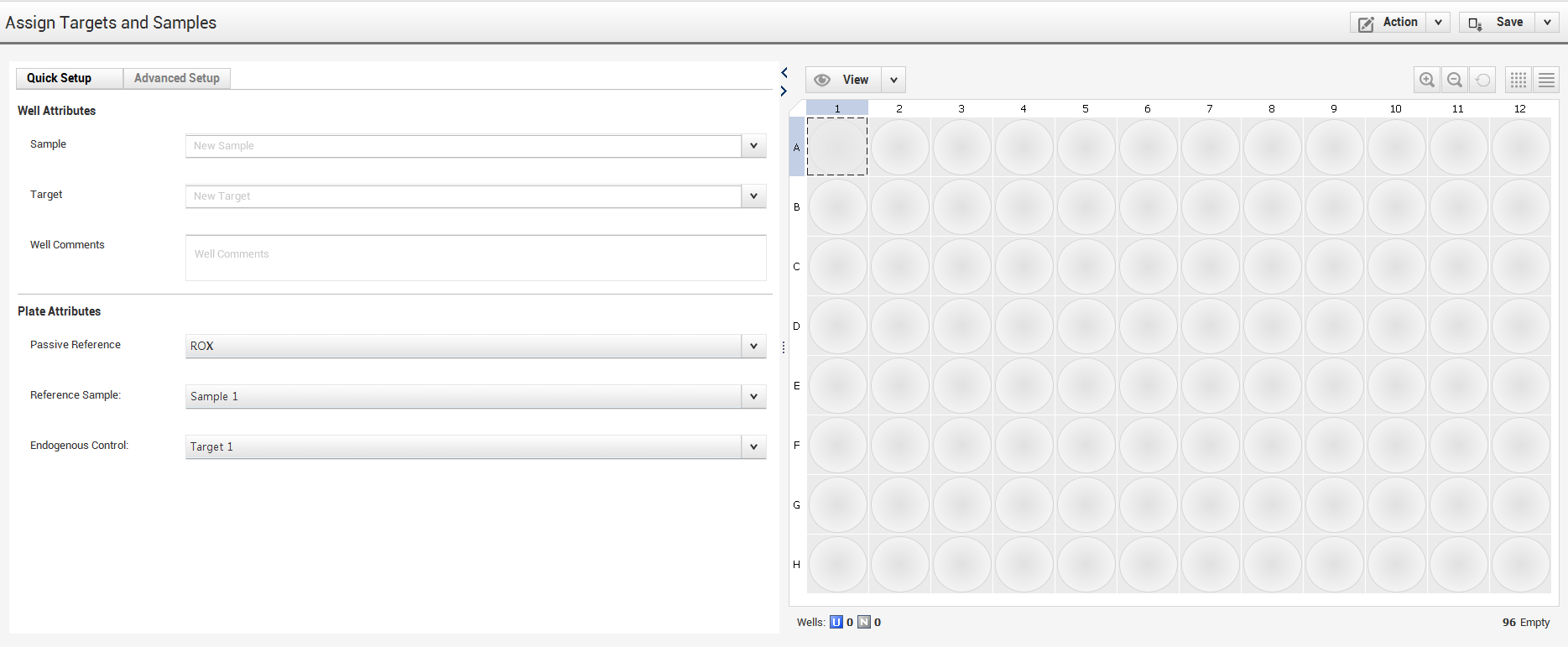
أنا أحب أشتغل على خانة الـ Advanced Setup لأنها أكثر مرونة وأسهل، لكن نشرح الواجهة هذه أولا.
حدد المربعات اللي لها نفس العينة -> خيار الـ sample اكتب فيه اسم الخلايا -> خيار الـ Target اكتب فيه اسم الجين المستهدف.
بالنسبة للـ Passive Reference: هي عبارة عن صبغة غالبا تكون مضافة مع الـ Master Mix –اقرأ محتويات الـ master mix، وغالبا راح يكتبون لك وش نوع الـ Passive dye المضافة، في وضعنا كانت ROX-. هي عبارة عن dye تعطي flurecence طول وقت التفاعل، ما تتأثر بأي عامل ثاني، فلو طلعت النتائج ولقيت أن الـ Passive reference ما تعطي flurecence منظم، بل متذبذب، هذا يعني أن الـ Master mix الخاص فيك فيه مشكلة، وبالتالي ضروري تغيره.
لو كانت شغالة صح فالمفترض تعطي plot كذا:
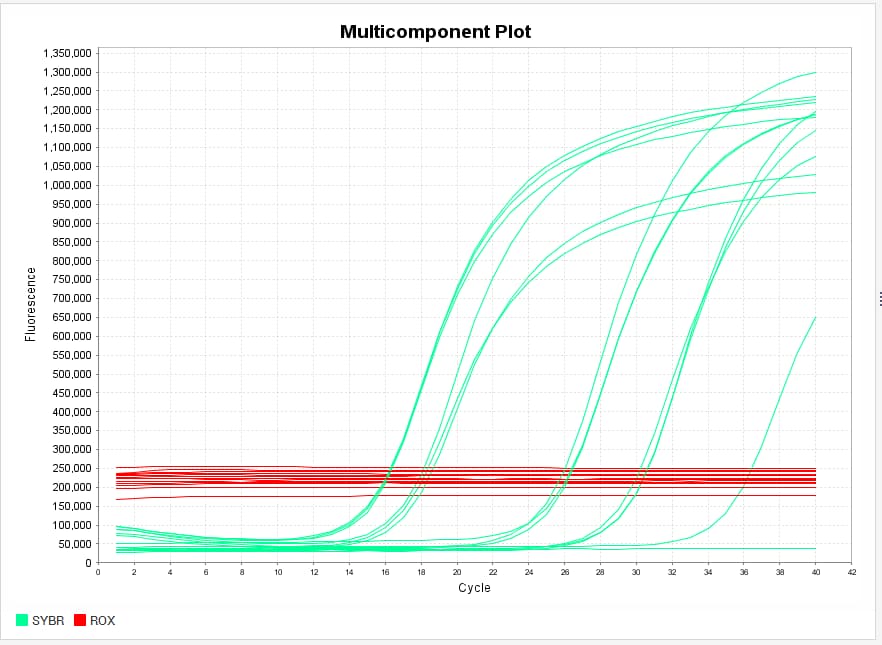
لاحظوا كيف الـ ROX يعطي خط منتظم، لو كان متذبذب فالنتائج غير صالحة ولازم نغير الـ Reagents.
نرجع لقائمة البيانات:
Reference Sample: طالما أن تجربتنها هي (Comparative Ct (∆∆Ct، فهذا يعني أن وجود عينة تُقارن النتائج بها، ففي مثال الخلايا السرطانية، الخلايا الطبيعية هي الـ reference sample.
Endogenous Control: هو الـ Reference gene or house-keeping gene.
الآن، نلاحظ في الأسفل وجود أيقونتين زرقاء ورمادية:

U= unknown
N= negative control= well that contains everything except cDNA sample. add nucleases-free water instead of it. VERY IMPORTANT.
كل well راح تحدد الـ Task الخاصة فيه، هل هو N أم U، وهذا موجود في الـ Advanced Setup، مثل ما هو واضح:
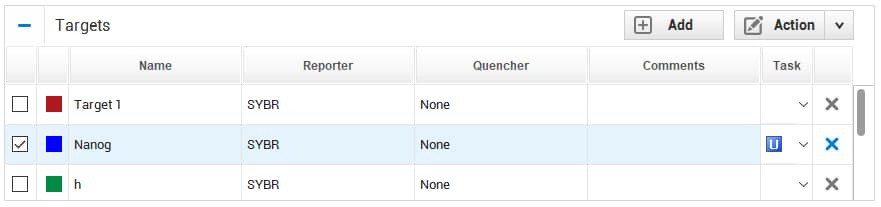
الشكل النهائي يفترض يكون كالتالي -من ناحية ملئ الفراغات-:

أخيرا Save، وبسم الله يبدأ الـ Run.
________________________________
بالنسبة للنتائج، وتحليلها، هذه قصة أخرى، في تدوينة أخرى، في وقت آخر، إن شاء الله.
________________________________
هنا مراجع مفيدة، ومفيدة بشكل خيالي، ولازم لازم لو ناوي تشتغل على الجهاز تقرأها بتركيز، وفيها أيضا Troubleshooting ترجع لها:
Real-time PCR handbook: https://www.gene-quantification.de/real-time-pcr-handbook-life-technologies-update-flr.pdf
QuantStudio™Design and Analysis Desktop Software- USER GUIDE: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0010408_QuantStudioDesign_Analysis_Desktop_Software_UG.pdf
(هذا المرجع يشرح النظام كاملا بكل الاستخدامات، وغالب الأشياء اللي تعلمتها اكتشفتها من هنا، قرأتها واجبة).

211 رد على “نظرة على كيفية عمل نظام جهاز QuantStudio 3 Real-Time PCR”
Sign up for our affiliate program and watch your earnings grow!
Earn passive income this month—become an affiliate partner and get paid!
Hi https://is.gd/9PLRLO
https://shorturl.fm/SQIbg
https://shorturl.fm/pbkEW
https://shorturl.fm/HdbeC
https://shorturl.fm/TQXJk
https://shorturl.fm/v06vM
https://shorturl.fm/To0to
https://shorturl.fm/RPelJ
https://shorturl.fm/ZNX4A
https://shorturl.fm/OLJWz
weed shipping usa secure packages
https://shorturl.fm/i7g9Y
https://shorturl.fm/eD63f
https://shorturl.fm/h7NIV
https://shorturl.fm/cLyY1
https://shorturl.fm/uW8O4
https://shorturl.fm/9Anz4
https://shorturl.fm/mCXTK
https://shorturl.fm/4Jiih
https://shorturl.fm/smPkY
https://shorturl.fm/4wN4g
https://shorturl.fm/ebBeU
https://shorturl.fm/l714u
https://shorturl.fm/NG8ul
https://shorturl.fm/yyXII
https://shorturl.fm/MQvnK
https://shorturl.fm/JWpgs
kamagra kanada online lékárna
kamagra generique
cheapest buy xifaxan cheap in canada
get xifaxan generic canadian
ordering rifaximin generic in canada
canadian rifaximin pharmacy
generic avodart in dubai
buy avodart generic from the uk
can i get staxyn without prescription
cheap staxyn purchase to canada
how to buy itraconazole buy in london
how to buy itraconazole cheap mastercard
purchase fildena purchase from uk
canadian pharmacy fildena reviews
cheapest buy gabapentin generic in united states
buy gabapentin without a perscription
online order flexeril cyclobenzaprine generic brand
purchase flexeril cyclobenzaprine price australia
buy cheap dutasteride cheap with prescription
dutasteride chicago where to buy
purchase androxal australia no prescription
order androxal cost tablet
purchase enclomiphene cost at walmart
how to buy enclomiphene generic a canada
donde comprar kamagra en galerias capon
kamagra prescrire eu medicament
https://shorturl.fm/8Gio9
https://shorturl.fm/iXVzZ
https://shorturl.fm/4KSbw
https://shorturl.fm/jWZq2
https://shorturl.fm/hutJt
https://shorturl.fm/YoxZY
https://shorturl.fm/LEl5o
https://shorturl.fm/cFup4
https://shorturl.fm/olVwp
https://shorturl.fm/4BLJN
https://shorturl.fm/nrU3g
https://shorturl.fm/xMRLv
https://shorturl.fm/OJVZh
https://shorturl.fm/6hNwL
https://shorturl.fm/wsrEl
https://shorturl.fm/hX7a7
https://shorturl.fm/zS0Ie
https://shorturl.fm/h3xkw
https://shorturl.fm/1YisY
https://shorturl.fm/psPtQ
https://shorturl.fm/8RNq8
https://shorturl.fm/OGsT2
https://shorturl.fm/UXJw4
https://shorturl.fm/M3oGf
https://shorturl.fm/n8p3U
https://shorturl.fm/u7GHr
https://shorturl.fm/4qTw4
https://shorturl.fm/C0V0g
https://shorturl.fm/uckyF
https://shorturl.fm/jau8P
https://shorturl.fm/ffxAv
https://shorturl.fm/8jWkd
https://shorturl.fm/zhD0A
https://shorturl.fm/uJHwA
https://shorturl.fm/lKzRm
https://shorturl.fm/9Htci
https://shorturl.fm/gE6w0
https://shorturl.fm/gZ0TE
https://shorturl.fm/TpxYP
https://shorturl.fm/WTJrv
https://shorturl.fm/zWnWx
https://shorturl.fm/n3xlm
https://shorturl.fm/ycMqz
https://shorturl.fm/oQrpg
https://shorturl.fm/bEdGO
https://shorturl.fm/He8qL
https://shorturl.fm/X7D5t
https://shorturl.fm/DL1Km
https://shorturl.fm/vvup8
Join our affiliate program today and start earning up to 30% commission—sign up now! https://shorturl.fm/MmfhN
Share our offers and watch your wallet grow—become an affiliate! https://shorturl.fm/jM5ku
Start profiting from your traffic—sign up today! https://shorturl.fm/Ot6gQ
Drive sales, earn big—enroll in our affiliate program! https://shorturl.fm/15bBO
Promote our brand and watch your income grow—join today! https://shorturl.fm/eunYI
Partner with us for generous payouts—sign up today! https://shorturl.fm/ojanI
Join forces with us and profit from every click! https://shorturl.fm/j2V8P
Boost your income—enroll in our affiliate program today! https://shorturl.fm/kJsUO
Get paid for every referral—enroll in our affiliate program! https://shorturl.fm/BtIgQ
Your audience, your profits—become an affiliate today! https://shorturl.fm/JizrJ
Start profiting from your network—sign up today! https://shorturl.fm/3GQTY
Be rewarded for every click—join our affiliate program today! https://shorturl.fm/zehso
Refer friends, collect commissions—sign up now! https://shorturl.fm/Wkz8Q
Earn passive income on autopilot—become our affiliate! https://shorturl.fm/2Zzrp
Refer friends, earn cash—sign up now! https://shorturl.fm/biFkI
Monetize your traffic with our affiliate program—sign up now! https://shorturl.fm/Lq2uI
Join forces with us and profit from every click! https://shorturl.fm/LJXdX
Share your link and rake in rewards—join our affiliate team! https://shorturl.fm/uZoiS
Your audience, your profits—become an affiliate today! https://shorturl.fm/vdDGD
Earn recurring commissions with each referral—enroll today! https://shorturl.fm/YjNlh
Boost your income—enroll in our affiliate program today! https://shorturl.fm/QCpNP
Unlock top-tier commissions—become our affiliate partner now! https://shorturl.fm/KZWq2
Invite your network, boost your income—sign up for our affiliate program now! https://shorturl.fm/iSDeA
Invite your network, boost your income—sign up for our affiliate program now! https://shorturl.fm/mPbUx
Drive sales, earn big—enroll in our affiliate program! https://shorturl.fm/EaI1i
Get started instantly—earn on every referral you make! https://shorturl.fm/qtNqc
Promote our brand and get paid—enroll in our affiliate program! https://shorturl.fm/bApLT
Promote our products and earn real money—apply today! https://shorturl.fm/DsdFi
Partner with us and enjoy recurring commission payouts! https://shorturl.fm/PefZe
Start profiting from your network—sign up today! https://shorturl.fm/Mupr5
Turn your audience into earnings—become an affiliate partner today! https://shorturl.fm/P6NH2
Share your link and rake in rewards—join our affiliate team! https://shorturl.fm/6l2fr
Start earning every time someone clicks—join now! https://shorturl.fm/5JHWr
Monetize your audience with our high-converting offers—apply today! https://shorturl.fm/VYGhR
Promote our brand and watch your income grow—join today! https://shorturl.fm/qdKwV
Promote our brand, reap the rewards—apply to our affiliate program today! https://shorturl.fm/jbRgO
Start earning every time someone clicks—join now! https://shorturl.fm/i9kbf
Start sharing our link and start earning today! https://shorturl.fm/hoouO
Share our link, earn real money—signup for our affiliate program! https://shorturl.fm/Tz5Cj
https://shorturl.fm/uyMvT
https://shorturl.fm/TDuGJ
https://shorturl.fm/0EtO1
https://shorturl.fm/eAlmd
https://shorturl.fm/ypgnt
https://shorturl.fm/f4TEQ
https://shorturl.fm/hQjgP
https://shorturl.fm/TDuGJ
https://shorturl.fm/xlGWd
https://shorturl.fm/0oNbA
https://shorturl.fm/FIJkD
https://shorturl.fm/bODKa
https://shorturl.fm/A5ni8
https://shorturl.fm/6539m
https://shorturl.fm/bODKa
https://shorturl.fm/6539m
https://shorturl.fm/N6nl1
https://shorturl.fm/5JO3e
https://shorturl.fm/j3kEj
https://shorturl.fm/5JO3e
https://shorturl.fm/bODKa
https://shorturl.fm/TbTre
https://shorturl.fm/68Y8V
https://shorturl.fm/TbTre
https://shorturl.fm/YvSxU
https://shorturl.fm/6539m
https://shorturl.fm/m8ueY
Best partnership https://shorturl.fm/A5ni8
Very good https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Good https://is.gd/N1ikS2
Good https://is.gd/N1ikS2
Very good https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Very good https://is.gd/N1ikS2
Very good https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Very good https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Very good https://is.gd/N1ikS2
Very good https://is.gd/N1ikS2
Very good https://is.gd/N1ikS2
Awesome https://is.gd/N1ikS2
Good https://is.gd/N1ikS2
Good https://rb.gy/4gq2o4
Good https://rb.gy/4gq2o4
Good https://rb.gy/4gq2o4
Very good https://rb.gy/4gq2o4
Very good https://rb.gy/4gq2o4
Good https://rb.gy/4gq2o4
Very good https://rb.gy/4gq2o4
Awesome https://urlr.me/zH3wE5
Awesome https://urlr.me/zH3wE5
Very good https://t.ly/tndaA
Awesome https://t.ly/tndaA
Very good https://t.ly/tndaA
Very good https://t.ly/tndaA
Very good https://t.ly/tndaA
Good https://t.ly/tndaA
Good https://short-url.org/10VGf
Awesome https://lc.cx/xjXBQT
Awesome https://lc.cx/xjXBQT
Very good https://shorturl.at/2breu
gQJxunmksOITBh
hnSjNXavlWA
shpfHReQJNAlLcFU
hcdSYpGQLor
SKqPBkcJzv
eFIrEHkdBwYON
QBtHSWpmcAoh
YuMzsEBHZoaO
FUsvVfoGbBrj
PdZoqtOn
lIvFfmqrRUGTPwc
JsYjxFghv
sbklmuZfeRHE
مقال جميل ومدونته أجمل ❤️❤️❤️
يعطيك ألف عافية، استفدت جداً من المعلومات المقدمة، شرح سلسل، وأسلوب لطيف، ولغة عربية رائعة، من النادر أن أجد محتوى عربي علمي بهذا الابداع
ما شاء الله تبارك الله، Keep it up plz
” …إن الله وملائكته وأهل السموات والأرضين حتى النملة في جحرها وحتى الحوت ليصلون على معلم الناس الخير”
الله يبارك لك ويزيدك من فضله 💖✨